Место серы в таблице Менделеева и ее роль в природе
Сера – один самых распространенных элементов земной коры (16-й по частоте встречаемости). Используется во многих сферах, начиная от промышленности и заканчивая медициной. Элемент активно взаимодействует с большинством известных металлов, взрывоопасна, плавится при температуре 119 градусов. Работать с серой нужно осторожно, чтобы не получить различные повреждения при нарушении техники безопасности.
История открытия
Сера имеет вид порошка из кристаллов желтого цвета. Оттенок их варьируется от светлого до темно-коричневого. В древности соединения серы использовались при проведении ритуальных обрядов. В Древней Греции добавляли элемент в горючие смеси, используемые в военных целях, в Древнем Китае – применяли для создания фейерверков, позже в Европе – для изготовления пороха. Среди алхимиков сера считалась «отцом всех металлов». Это связано с тем, что она активно вступает в связь с большинством металлов, поэтому поверхность их почти всегда покрыта сульфидным слоем.
Научный подход в исследовании серы применил Лавуазье. В результате многочисленных опытов с горением порошка он установил его химические свойства.
Сера в таблице Менделеева
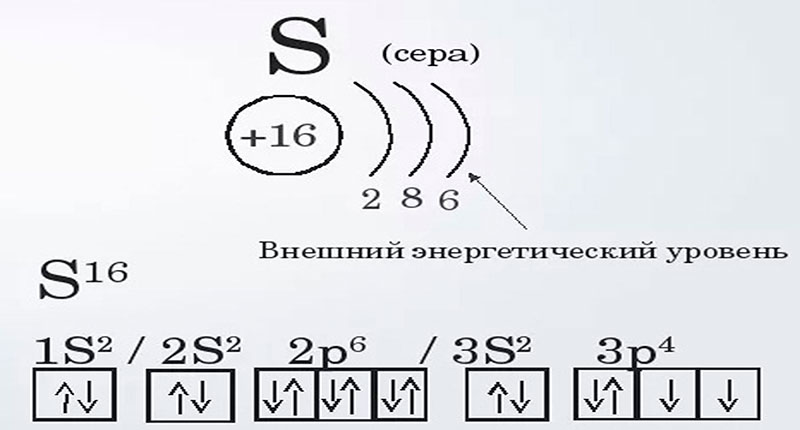
Элемент обозначается «S». Находится в 3 периоде таблицы Менделеева, 16-й порядковый номер. Относится к неметаллам. Имеет:
- атомную массу 32,065;
- заряд ядра +16.

Строение атома серы
Около ядра вращаются электроны на 3 уровнях: первый и второй полностью заполнены, на третьем 6 электронов, то есть не хватает до устойчивого состояния. Электроны могут занимать разные позиции, переходить на d-подуровень 3 уровня. В зависимости от этого сера принимает валентность -2, +2, +4, +6. Радиус атома – 127 пм.
Физические свойства
Основные свойства серы известны давно, еще до существования научных объяснений этим явлениям:
- сера взрывоопасна, горит, при этом образуются токсические летучие серные соединения (сероводород, сернистый газ, серный ангидрид). Есть сложности с улавливанием продуктов горения элемента. Для этого необходимо специальное оборудование;
- для плавления достаточно температуры 119°C;
- вещество не растворяется в воде. Можно использовать в качестве растворителей для серы бензол и сероуглерод;
- плохо проводит тепло и электрический ток;
- плотность серы составляет 2,07 г/см³.
Сера входит в состав многих соединений. Все они отличаются физическими свойствами и агрегатным состоянием.
Свободная сера может иметь вид цепочек из нескольких атомов. Соединены они между собой ковалентной неполярной связью. Состав химического элемента сера – S4, S6, S8, Sn. Цепочки элемента бывают открытыми и замкнутыми. Из-за этого есть несколько аллотропных модификаций серы:
- ромбическая и моноклинная (циклическая формула S8) – желтая кристаллическая, хрупкая;
- пластическая – коричневая тянущаяся масса. Получить можно, если расплавленное вещество вылить в холодную воду.
Сера входит в состав:
- сероводорода (H₂S);
- оксида серы (SO₂, SO₃);
- сульфидов (с металлами – FeS₂, ZnS, PbS);
- сульфатов (CaSO₂);
- сульфитов (Na2SO₃);
- серной (H₂SO₄) и сернистой кислоты (H₂SO₃).

Химические свойства
Получают серу:
- из сульфидов металлов при их термическом разложении;
- из диоксида серы при добавлении углерода;
- при окислении сероводорода кислородом или диоксидом серы (SO₂), при нагревании и в присутствии катализатора;
- выделяют из нефтепродуктов и природного газа при их очистке;
- серные бактерии окисляют сероводород и накапливают серу.

Добыча вещества связана с опасностью, так как залежи серы склонны к самовозгоранию и выделению токсичных газов.
Главные химические свойства элемента:
- вступает в реакцию с металлами с образованием тепловой энергии;
- образует сульфаты;
- с кислородом получается диоксид серы;
- образует дисульфид углерода (CS₂) при нагревании ртути до 800-900 °C, в реакцию вступают пары серы;
- при соединении с ртутью выпадает осадок – реакция демеркуризации.
Сера проявляет себя как восстановитель, то есть отдает электроны в реакциях:
- с кислородом при нагревании;
- с галогенами – активнее всего реагирует с фтором. Для соединения с бромом, хлором необходимо нагревание. С йодом не взаимодействует;
- с некоторыми кислотами – серной, азотной.

Сера принимает электроны, то есть ведет себя как окислитель, в реакциях:
- с металлами (при обычной температуре или при нагревании);
- с водородом при нагревании до 150-200 °C образуется сероводород;
- с некоторыми неметаллами (с меньшим значением электроотрицательности – с углеродом, фосфором при отсутствии доступа воздуха);
Ни при каких условиях сера не реагирует с золотом, платиной, иридием, инертными газами.
Что касается соединений серы:
- сероводород (S 2-) – сильный восстановитель в химических реакциях;
- серная кислота и оксид серы SO₃ (S 6+) – сильные окислители;
- оксид серы SO₂, сернистая кислота (S 4+) проявляют себя двояко в зависимости от свойств другого реагента.

Сера в природе
Элемент находится в природе в свободном виде или в виде сложных соединений:
- сера самородная в свободном состоянии встречается на территории США, Италии, Средней Азии. Она находится в виде небольших вкраплений в других породах. Одна из теорий – вещество образуется из гипса, ангидрита (CaSO₄). Самое большое месторождение – остров Итуруп – порядка 4 227 тысяч тонн;
- сероводород содержится в минеральных водах многих источников, в смеси вулканических газов;
- в воде – от количества сульфат-ионов зависит ее жесткость;
- элемент входит в состав аминокислот, поэтому при гниении белка образуется сероводород;
- у человека и животных сера сконцентрирована в основном в волосах, шерсти;
- в составе сульфидов – железный колчедан (FeS₂), киноварь (HgS), медный блеск (Cu₂S), цинковая обманка (ZnS);
- кристаллогидрат сульфата кальция (CaSO₄*H₂O) – гипс;
- элемент присутствует в нефти, природном газе (сероводород, сернистый ангидрид), угле, сланцах.
Применение
Сера используется во многих отраслях:
- в агропромышленности гранулированная сера используется в качестве удобрения. Она стимулирует реакции фотосинтеза, губительно действует на вредителей, грибы;
- в косметологии, медицине, фармацевтике – мази с антипаразитарным, противомикробным, противогрибковым действием;
- в травматологии, хирургии – гипс для фиксации конечностей при переломах;
- в животноводстве, пчеловодстве порошок используют для борьбы с болезнями;
- в нефтегазовой отрасли для очистки от примесей серы. Если она оседает на стенках трубопровода, оборудование быстро выходит из строя;
- легкая промышленность – изготовление тканей, целлюлозы;
- химическая отрасль – делают резину;
- используют при изготовлении оптики, люминофоров;
- входит в состав моющих средств, дорожного покрытия – сероасфальт, серобетон;
- производство спичек, бенгальских огней, пиротехнических смесей, черного пороха;
- в виде серной кислоты – очищает топливо от масляных примесей;
- серная кислота хорошо вбирает водяные пары, поэтому играет роль осушителя – используют для предотвращения образования инея на окнах при минусовой температуре;
- из серного ангидрида получают серную кислоту;
- сульфиды используют для получения металлов.
Этим перечнем не исчерпывается область применение серы.
Сера – одно из самых распространенных веществ на Земле. Элемент очень важен как для промышленности, так и для самого человека. Его добывают практически на всех континентах. Широко используют в медицине, агропромышленности, нефтегазовой отрасли и прочих.
Какие интересные факты о сере вы еще знаете? Оставьте комментарий, в какой отрасли вы сталкивались с этим элементом. Поделитесь с друзьями статьей, сохраните ее в закладках, чтобы при необходимости можно было к ней вернуться.
Сера: химические свойства, аллотропия и её соединения. Об этом в видео ниже.
Источники:
- http://www.chem.msu.su/rus/history/element/S.html
- https://ru.wikipedia.org/wiki/Сера









Отзывы и комментарии